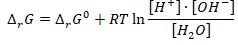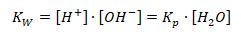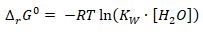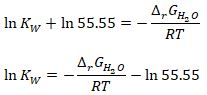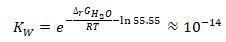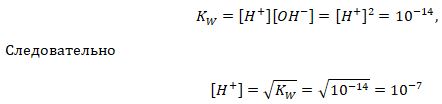Химия для взрослых и детей: водородный показатель рН
Всем знакомо понятие водородного показателя - рН. Для тех, кто не помнит, рН - это отрицательный десятичный логарифм концентрации «ионов» водорода. Ион – это заряженная частица. Для тех, кто в теме, под ионами водорода читайте ионы гидроксония (Химическая энциклопедия: В 5 т.: т.1 / Ред. кол.: Кпунянц И.Л. (гл. ред.) и др. – М.: Сов.энцикл., 1988.Вода).
где [H+] - концентрация ионов водорода в водных растворах, выраженная в моль/л (квадратными скобками принято обозначать равновесную концентрацию вещества).
А в чём же физическая природа данного понятия? На основании рН можно определять концентрацию растворов кислот и щелочей. Об этом я расскажу ниже.
Начнём с общих понятий. Вода является слабо диссоциирующим соединением. Диссоциация – это реакция распада молекул вещества на ионы (Нобелевская премия 1903 года). В упрощённом виде этот процесс можно представить в виде следующей реакции:

Этот процесс является обратимым, т.е. непрерывно происходит диссоциация (распад) молекул воды на ионы и обратный процесс ассоциации (слияние) ионов в молекулу воды. В деионизованной воде (как я понимаю, это вода, из которой удалены все ионы и газы) концентрация ионов водорода [Н+] равняется концентрации гидроксид-ионов [ОН-]. В стандартных условиях (298 К и 1 атм) для такой воды рН = 7 (что соответствует концентрации ионов водорода 10^-7 моль/л = 0.0000001 ).
Но не думайте, что рН питьевой воды должен быть равен 7. В норме за счёт естественной минерализации воды и растворения различных газов (в первую очередь углекислого газа) рН = 5,5 (точнее не скажу, может меня поправят). По моему скромному мнению, пить как деионизованную, так и дистиллированную воду вообще не полезно, так как они вымывают из организма полезные микро- и макроэлементы.
Давайте разберёмся, как определена эта цифра рН = 7для нейтральной среды? Я объясню его на основании теоретического расчёта (все термодинамические величины были определены экспериментально, но не мною).
Для этого нам потребуется уравнение химического потенциала указанной реакции диссоциации воды:
где ΔrG - энергия Гиббса реакции, и так как процесс равновесный, энергия Гиббса реакции равна нулю (ΔrG = 0, кДж/моль); R – постоянная газовая, Дж/(моль*К) ; Т – абсолютная температура по шкале Кельвина. Он выводится из второго закона термодинамики,
где 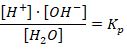
откуда путём нехитрых преобразований:
В итоге с теоретической точки зрения ионное произведение воды можно представить в виде:
Строго говоря, величина тоже зависит от температуры, и её можно высчитывать по табличным данным термодинамических величин.
В стандартных условиях ионное произведение воды можно определить по формуле:
Бонусом приведу сайт с углубленным расчётами ионного произведения воды, при разных температурах и давлении на основе маткада.
Этот расчёт, а также несколько альтернативных формул можно найти в статье (БУШУЕВ Е.Н РАСЧЕТ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ ИОННОГО ПРОИЗВЕДЕНИЯ, УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ ВОДЫ И ПРЕДЕЛЬНО РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ «Вестник ИГЭУ» Вып. 2 2007 г)
Как я указывал выше, для деионизованной воды равновесные концентрации ионов водорода и гидроксид-ионов равны:
Тем самым мы определили, что для деионизированной воды при стандартных условиях рН = 7. Теперь вы знаете, как определили значение рН нейтральной среды. А ионное произведение воды показывает возможный диапазон рН водных растворов, т.е. в стандартных условиях рН может варьироваться от 0 до 14. При добавлении кислот будет расти значение концентрации водорода, а концентрация гидроксид-ионов падать, т.е. рН < 7, и среда будет в таком случае кислой, и минимальное значение будет равно 0 (если упростить). И наоборот, при добавлении щелочей будет расти концентрация гидроксид-ионов, т.е. рН > 7, и такую среду следовательно называют щелочной, максимальное значение (в упрощённом предсттавлении) рН = 14. Эти явления можно объяснить следующим образом: кислоты легко распадаются (диссоциируют) на ионы водорода и кислотный остаток, а щелочи являются источниками гидроксид-ионов. На этом и основано его применение: на основании рН можно определять концентрацию растворённых веществ, смещающих равновесие указанной в самом начале реакции. На практике используют два способа определения водородного показателя: 1) с помощью химических индикаторов, меняющих окраску в зависимости от рН; 2) потенциометрическим методом, устройством, состоящим из стандартного электрода сравнения и преобразователя напряжения электрода в цифровое значение рН.

Данное фото иллюстрирует каким окрашиванием будут обладать несколько распространённых рН индикаторов в зависимости от рН среды.
А вот теперь перейдём от простого к сложному. Я думаю, что даже химики не часто задумываются, а всегда ли диапазон рН для водных растворов будет 14? По литературным данным этот диапазон при 1 атм в интервале температур от 273 до 623К варьируется от 15 до 11 соответственно. Это можно проверить расчётом на основе приведённой мною формулы, связывающей термодинамические величины и ионное произведение воды. А физически это объясняется тем, что с ростом температуры диссоциация воды увеличивается, следовательно, растёт и Kw, при понижении температуры — наоборот.
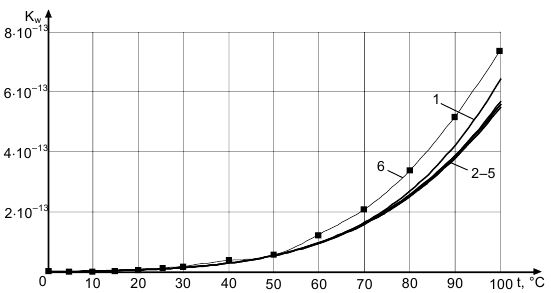
На данном рисунке приведено как меняется рН чистой воды в разном диапазоне температур. Т.е. при 99 градусах (выше 100 градусов необходимо учитывать дополнительные параметры) воде с нейтральной средой будет соответствовать рН = 6.1.
Теперь вы знаете, что такое водородный показатель: pH = - lg[H+]. С помощью него определяют концентрацию растворов кислот и щелочей. На практике при 25 градусах по Цельсию диапазон рН равен 14, но при других температурах он может быть иным. Нейтральная среда имеет рН = 7, а питьевая вода имеет слабокислый, примерно равный рН = 5,5.
Основным источником информации и последнего графика для меня послужила статья:
БУШУЕВ Е.Н РАСЧЕТ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ ИОННОГО ПРОИЗВЕДЕНИЯ, УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ ВОДЫ И ПРЕДЕЛЬНО РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ «Вестник ИГЭУ» Вып. 2 2007 г.
Всем спасибо. Проект написан для биржи тем и надеюсь @sci-populi меня не забудет.