Водородная энергетика: методы получения водорода и экономические оценки
Пост будет посвящён водородной энергетике, а в частности промышленным и перспективным методам производства водорода и их экономической оценке. К водородной энергетике я подошёл от описания истории изучения водорода в предыдущем посте. При достаточных мощностях производство водорода способно удовлетворять большую часть энергетических потребностей человечества [1,2]. В качестве основных источников водорода выступают углеводородное (ископаемое) топливо и вода. В настоящее время водород в основном производят из ископаемых видов топлива (природный газ, нефть и уголь). Но при получении водорода из любого сырья, содержащего углерод (в том числе из спирта и при пиролизе биомассы), возникает проблема парниковых газов, и экологически чистыми их всё же назвать нельзя. Привлекательно выглядит получение водорода посредством электролиза воды, где в качестве источников энергии будут выступать возобновляемые источники энергии. Основная проблема возобновляемых источников энергии - это вынужденное хранение накопленной энергии, т.е. большую часть времени аккумуляторы простаивают без дела. А непрерывное преобразование этой энергии в водород позволяет получать экологически чистое топливо, которое может выступать в качестве горючего и источника энергии в топливных элементах [3]. В качестве доводов приводятся следующие тезисы:
- водород с высокой степенью эффективности получают и преобразовывают в электроэнергию;
- в качестве сырья используют воду (я думаю, не стоит упоминать о её количествах);
- водород относится к возобновляемым ресурсам, т.к. после окисления (кислородом) мы получаем воду;
- его можно хранить в газообразном, жидком состоянии и в форме легко разрушающихся гидридов металлов;
- водород можно транспортировать по газопроводам и танкерами;
- это замечательное топливо можно легко преобразовывать в другие формы энергии и сырья.
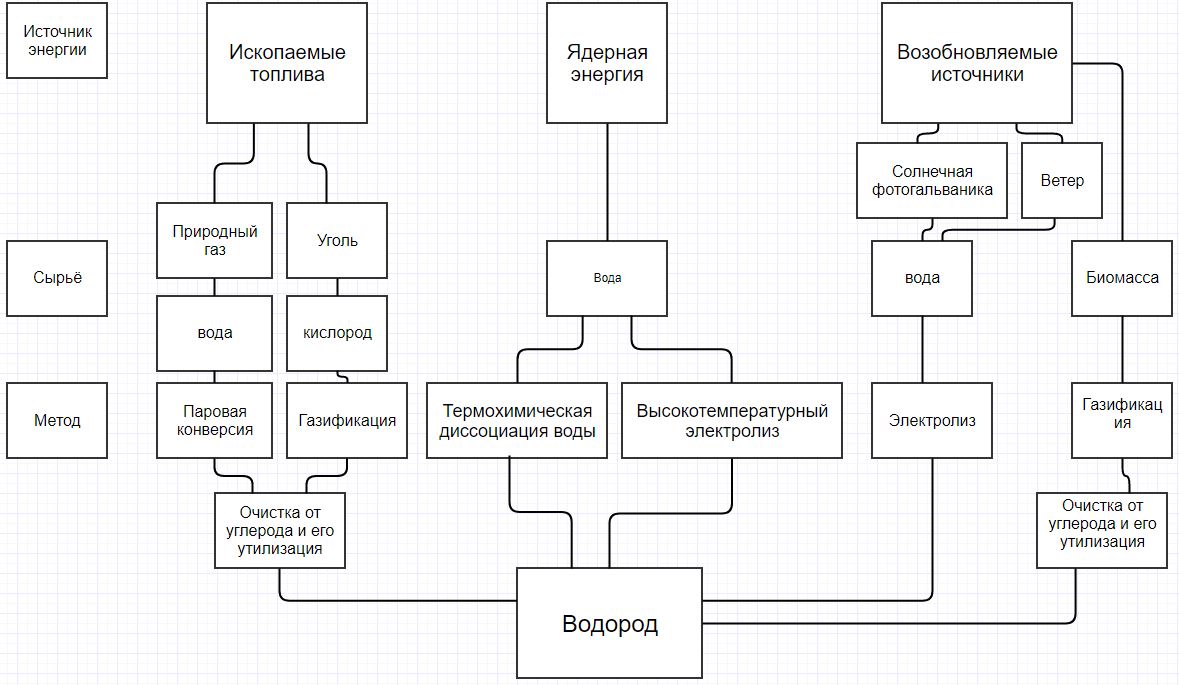
Для наглядности основные методы получения водорода я представлю в форме диаграммы [4]
Получение водорода методом электролиза воды - самая очевидная и эффективная технология (энергетическая эффективность 72 - 82 %.). Существуют различные варианты осуществления электролиза (работы 80-х годов):
а) электролиз в щелочной среде с выходом до 90 % [5];
б) электролиз в твердых полимерных электролитах (процесс происходит в протон-проводящей ионообменной мембране, выступающей в качестве электролита и сепаратора водорода [6]);
в) высокотемпературный электролиз водяного пара (при 700 °C и 1000 °C с ион-проводящей керамикой-электролитом [7]).
Напомню, в процессе электролиза вода под действием постоянного тока вода разлагается на газообразные водород и кислород. Для получения 1 м3 (90 г) водорода необходимо 805 г воды и 2394 А*ч электричества. Процесс можно проводить при различных температурах; с ростом температуры необходимое для электролиза напряжение снижается. Это связано тем, что разложение воды можно осуществлять прямым преобразованием внешней теплоты, и с ростом температуры эта доля растёт, достигая максимума при 4700 градусах по Цельсию. По известным данным высокий КПД = 0,92 достигается при 150 градусах по Цельсию [8].
В качестве примера электролизера я рассмотрю один из типов щелочного электролизера. Электрохимическая ячейка состоит из пористой диафрагмы-сепаратора, на поверхность которой нанесён катализатор. Эта диафрагма заполнена электролитом. Генерация газа происходит на внутренней поверхности каталитического слоя. Металлические электроды, соприкасающиеся с катализатором, разделяют электрохимические ячейки и обеспечивают сепарацию продуктов электролиза.
Реакции на электродах электролизера записывают в виде:
катод:
e^-+H2O→0,5H2 O+OH^-
анод:
OH^-→0,25O2+0,5H2 O+e^-
Особенно интересен электролиз воды в паре с возобновляемыми источниками энергии и, в частности, с фотоэлектрическими элементами (хотя КПД такой пары не превышает и 10% [9] и даёт довольно дорогой продукт). В этом направлении ещё в 80-х годах выполнены как теоретические, так и экспериментальные исследования [10].
Для отработки рассматриваемых технологий были запущены в эксплуатацию следующие экспериментальные заводы: Wasserstoff (Нойнбург-форм-Вальд, Германия) [11], HYSOLAR (Саудовская Аравия) [12], Schatz energy research center (Университет Гумбольдта, Арката, Калифорния) [13], опытное производство в технологическом университете Хельсинки (Хельсинки, Финляндия) [14] и энергетическая лаборатория INTA (Уэльва, Испания) [15].
Из всех методов электролиза наиболее перспективным считают высокотемпературный электролиз (себестоимость водорода от 2,35 до 4,8 $/кг [16]). В качестве главного недостатка данного метода указывают высокие капиталовложения. Но не смотря на это, для малотоннажного (до 10 тонн/день водорода) производства электролиз коммерчески оправдан. В будущем рассчитывают на снижение затрат на оборудование за счёт новых разработок. С точки зрения экологии электролиз может показаться относительно чистым и безотходным методом, хотя нельзя забывать, что электроэнергия сегодня производится из ископаемого топлива с большим выделением углекислого газа. Стоимость килограмма водорода по такой технологии по отношению к прочим методам средний (порядка 3,5 -4,5 $/кг). В конце статьи я сравню различные экономические оценки методов производства водорода.
Термохимическими циклами получения водорода называют химическое расщепление воды при температурах ниже необходимых для термолиза (диссоциации под действием высокой температуры - не ниже 2300 градусов по Цельсию) посредством серии циклических химических реакций. В ходе этих реакция потребляется вода, а высвобождаются водород и кислород. Простой случай двухстадийного термохимического процесса разложения воды представляют следующими реакциями:
H2O+X→Y+H2;
Y→X+0,5O2
Вот некоторые из исследованных термохимических циклов: [17 - 19]:
S-I цикл:
I2+SO4+2H2O→2HI+H2 SO4 (120℃)
2H2SO4→2SO2+2H2O+ O2 (830℃)
2HI→ I2+H2 (450℃)
гибридный S цикл:
H2SO4(г)→ 2SO2+ H2O+0,5O2 (850℃)
SO2(ж) +2H2O →H2SO4(ж)+H2 (80℃ электролиз)
Также изучены циклы CaBr–Fe3O4, Fe–Cl, и Cu-Cl [20].
Максимально достижимая конверсия водорода в указанных процессах 40 % - 50 %. Относительно высокие затраты на перемещения больших объёмов материалов в химических реакциях, токсичность и коррозия аппаратуры при указанных температурах препятствуют развитию данной технологии. А в качестве источников энергии для подобных процессов рассматривают исключительно атомную энергию. Оценочная стоимость водорода при таком методе одна из самых низких (порядка 1,5 – 2,7 $/кг), но требования безопасности к ним самые высокие, хотя с точки зрения экологии они считаются самыми чистыми, т.к. атомная энергетика не выделяет парниковых газов и на выходе только водород и кислород, тут конечно есть с чем поспорить.
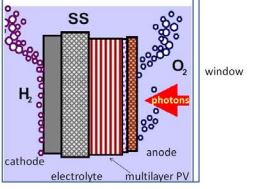
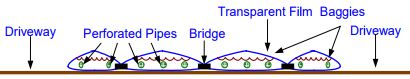
Фотолиз воды представляется собой прямую конверсию водорода с помощью солнечного света.
Схема фотолиза воды:
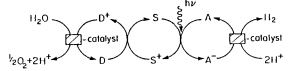
Существует множество различных вариантов реализации фотодиссоциации воды [21]:
- Окислительно-восстановительные фотокатализаторы, представляющие собой фотохимические ячейки, в которых на поверхности катализатора под действием падающего света вода термокаталитически разлагается на водород и кислород.
- Коллоидные полупроводники. Это фотоэлектрохимические элементы, которые представляют собой неглубокие горизонтальные ванны, заполненные водой, наночастицами и электролитом KОН. Поверх такой ванны натянута тонкая эластичная пропускающая свет пластиковая пленка, или мешковина, чтобы удерживать суспензию и вырабатываемый газ.
- Иммобилизованные ферменты и отдельные микроорганизмы. Подобные фотобиологические системы способны преобразовывать солнечную энергию в водород, например цианобактерии.
Методы преобразования солнечной энергии в водород демонстрируют широкий разброс себестоимости в зависимости от метода. Самым дорогим методом будет преобразование солнечной энергии в электричество с последующим электролизом воды (по разным оценкам от 10,4 $/кг [22] до 4 – 5,4 $/кг [23]), т.к. необходимо учитывать стоимость дополнительного электролитического оборудования. Наиболее выгодным являются методы, описанные в пунктах 1, 2 (1,6 - 3,4 $/кг). Данные методы никогда не потягаются в эффективности с массовым производством, т.к. энергоёмкость их невелика. Экологичность данных методов по оценке специалистов [24] средняя, что как я понимаю, связано с неэкологичными методами производства и утилизации полупроводниковых приборов, из которых изготавливаются фотоэлементы.
В качестве источников такого сырья могут выступать: каменный и бурый уголь, нефть и природный газ. Попробую дать представление о каталитическом риформинге на примере конверсии метана (паровая конверсия метана). Метод паровой конверсии метана на данный момент является самым главным способом мирового производства водорода. Это связанно с относительной дешевизной метана и высоким относительным содержанием водорода в молекуле метана, так как соотношение С/Н в нём самое высокое относительно всех остальных углеводородов. Пример подобного реактора можно увидеть в моей статье про синтез-газ (даже не смотря на то, что в качестве сырья используют уголь). Очищенный от примесей газ и водяной пар поступают в реактор (рабочая область 9 - 10 метров), представляющий собой множество трубок (90 – 130 мм), заполненных катализатором. Температура в реакторе регулируется с помощью теплоносителя, протекающего между трубок. Под действием температуры 1073 – 1123 К и высокого давления на поверхности катализатора протекают следующие реакции :

В качестве интересного ответвления можно рассмотреть получение водорода с использованием воды сверхкритических параметров (температура выше 347 градусов по Цельсию и давление выше 217 атм):
1.Пиролиз в СВ (сверхкритической воде)
- Полное окисление в СВ и кислороде. Газификация органических соединений (угля) в отсутствии катализаторов и избытке окислителя (кислород) при молярном соотношении кислорода и углерода 1:1 или выше.
- Газификация в СВ и с катализатором. Газификация органических соединений (угля) в отсутствии окислителя и на катализаторе, также известная как низкотемпературная газификация.
- Частичное окисление в СВ - это окисление органических соединений с окислителем без катализатора в молярном соотношении кислорода к углероду менее 1.
- Последовательная газификация с частичным окислением. Газификация органических соединений в присутствии катализатора с последующей газификацией органических соединений в присутствии окислителя при молярном соотношении кислорода к углероду меньше 1, т.е. комбинирование 3 и 4 методов.
Подобным образом основано получение водорода на основе паровой конверсии угля. Данные методы производства водорода справедливо можно отнести к самым «экологически грязным» т.к. в процессе выделяется большое число углекислого и сернистого газов (в этом плане уголь вообще жуть). Но стоимость полученного таким образом водорода самая низкая, что связано с невысокой стоимостью оборудования и сырья. Также стоит отметить хорошее масштабирование производства.
Водород может быть получен из биомассы путем пиролиза/газификации [25]. Биомассу и воду под давлением в реакторе нагревают до высоких температур. Этот процесс приводит к разложению и частичному окислению биомассы в газовый продукт, состоящий из водорода, метана, оксидов углерода и азота. Золу удаляют из нижней части реактора либо в жидком либо в твёрдом состоянии. Газовый поток поступает в высокотемпературный реактор, где содержание водорода увеличивается. Затем на адсорбционной установке производят очистку водорода от примесей. Процесс является модификацией газификации угля, за исключением установки предварительной обработки биомассы и конструкции реактора. Из-за заметно меньшей энергоёмкости биомассы на единицу массы по сравнению с углем, размер газификатора биомассы обладает большими размерами по сравнению с установками газификации угля.
Существует метод безводного и бескислородного каталитического получения водорода из углеводородных газов (Kværner process). В принципе он схож с пиролизом по своей сути.
Большой интерес к данной разновидности каталитического пиролиза научное сообщество проявляло в 80-х - 90-х годах прошлого столетия. Данный процесс интересен тем, что в продуктах реакции содержание оксидов углерода мало или пренебрежимо низкое (если ваш реактор достаточно герметичен и работает при повышенном давлении), и фактически получают только водород и сажу. При правильном подборе катализатора и параметров процесса вместо сажи можно с успехом получать многостенные углеродные нанотрубки, хоть и загрязнённые катализатором, на поверхности которого они и формируются. Процесс в упрощённом виде представляют реакцией:
CHm→nC+m/2 H2

Лирическое просвещение.
В первых исследованиях процесс осуществляли в районе1873 К, затем температуру процесса смогли снизить до 1073 – 873 К в зависимости от катализатора. Температурная зависимость конверсии метана при атмосферном давлении проходит через пик, что связно со сплавлением частиц катализатора в крупные частицы, и это приводит к снижению эффективности пиролиза. Традиционными катализаторами разложения метана являются металлы 8-10 групп (длинной периодической таблицы Менделеева) и их сплавы. В последнее время используют би- и триметаллические системы катализаторов. Особой популярностью пользуются катализаторы на основе никеля, что вызвано высоким сродством никеля к углероду (В. И. Стукачев, И. С. Чуканов, А. М. Глушенков, Д. Г. Кувшинов ПРИМЕНЕНИЕ Ni-Pd КАТАЛИЗАТОРОВ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА РАЗЛОЖЕНИЕМ МЕТАНА). Эффективность разложения метана зависит от свободной поверхности катализатора, но так как на поверхности катализатора растут углеродные нанотрубки, она постепенно снижается. И поэтому непрерывно этот процесс проводить не получится, из-за необходимости очистки катализатора от многостенных углеродных нанотрубок, что является весьма заметным недостатком. В общем, процесс интересный, но увы имеющий большие проблемы с масштабированием в виду недостаточного изучения химизма процесса и невозможностью организовать непрерывное производство.
Рассмотреть методы производства интересно, но особенно любопытно сравнить экономические параметры рассмотренных процессов получения водорода. Как говорил один известный персонаж: «Прежде чем продать что-нибудь ненужное, нужно купить что-нибудь ненужное», т.е. нужно оценить капитальные затраты на постройку производства. Ниже приведены данные из двух источников по стоимости строительства заводов.
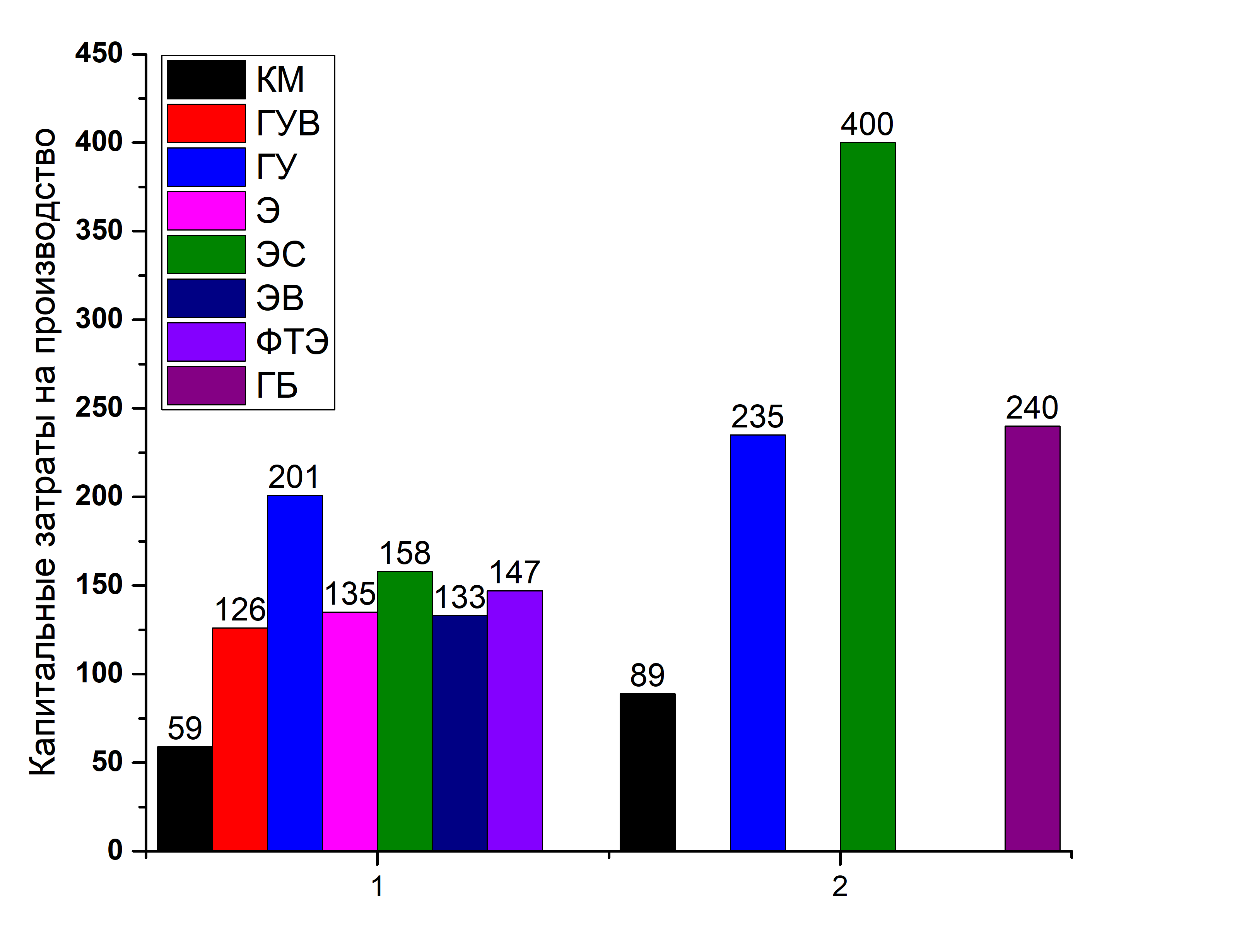
Где КМ – паровая конверсия метана; ГУВ – газификация углеводородов; ГУ – газификация угля; Э – электролиз; ЭС – электролиз от энергии солнечных элементов; ЭВ – электролиз от энергии ветра; ФТЭ – фототермоэлетролиз (фотолиз по типу 2); ГБ – газификация биомассы. Указанные значения я нормировал на производство 100 млн. тонн/день.
Видно, что оценки могут сильно различаться. Самое интересное, что все найденные мною оценки относятся к 2001 – 2003 годам, и на эти работы ссылаются до сих пор.
Данные по капитальным затратам на заводы 1 [26], 2 [27].
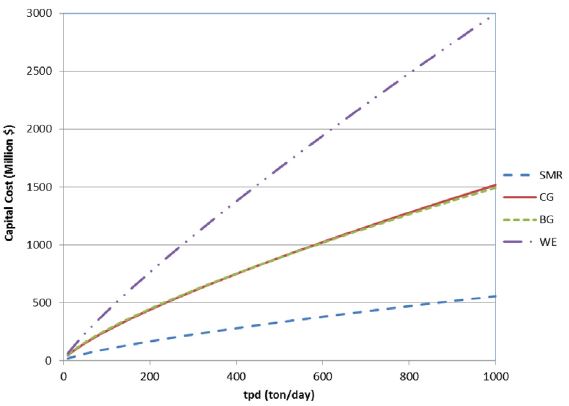
На данном рисунке рассмотрена масштабируемость разных методов получения водорода, т.е. зависимость капитальных затрат на производство при росте производительности. Где SMR – паровая конверсия метана, CG – газификация угля, BG – газификация биомассы, WE – электролиз воды. На счёт близких значений газификации угля и биомассы я бы поспорил, т.к. стоимость биомассы зависит от её непостоянных поставок и металлоёмкость установок газификации (биомассы) выше. Также технологическая оснастка газификации биомассы будет сильно зависеть от типа биомассы в каждом конкретном случае.
Также проведена оценка стоимости килограмма водорода в зависимости от стоимости кВт*часа энергии для электролиза.
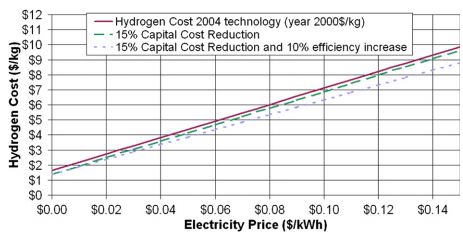
Данные не сказать, чтобы новые, но позволяют оценить стоимость производства водорода электролизом
И заключение я привожу оценки стоимости производства килограмма водорода в зависимости от метода его производства. Она сильно зависит от технологического решения, например, эффективность солнечных батарей постоянно растёт, а себестоимость их производства падает.
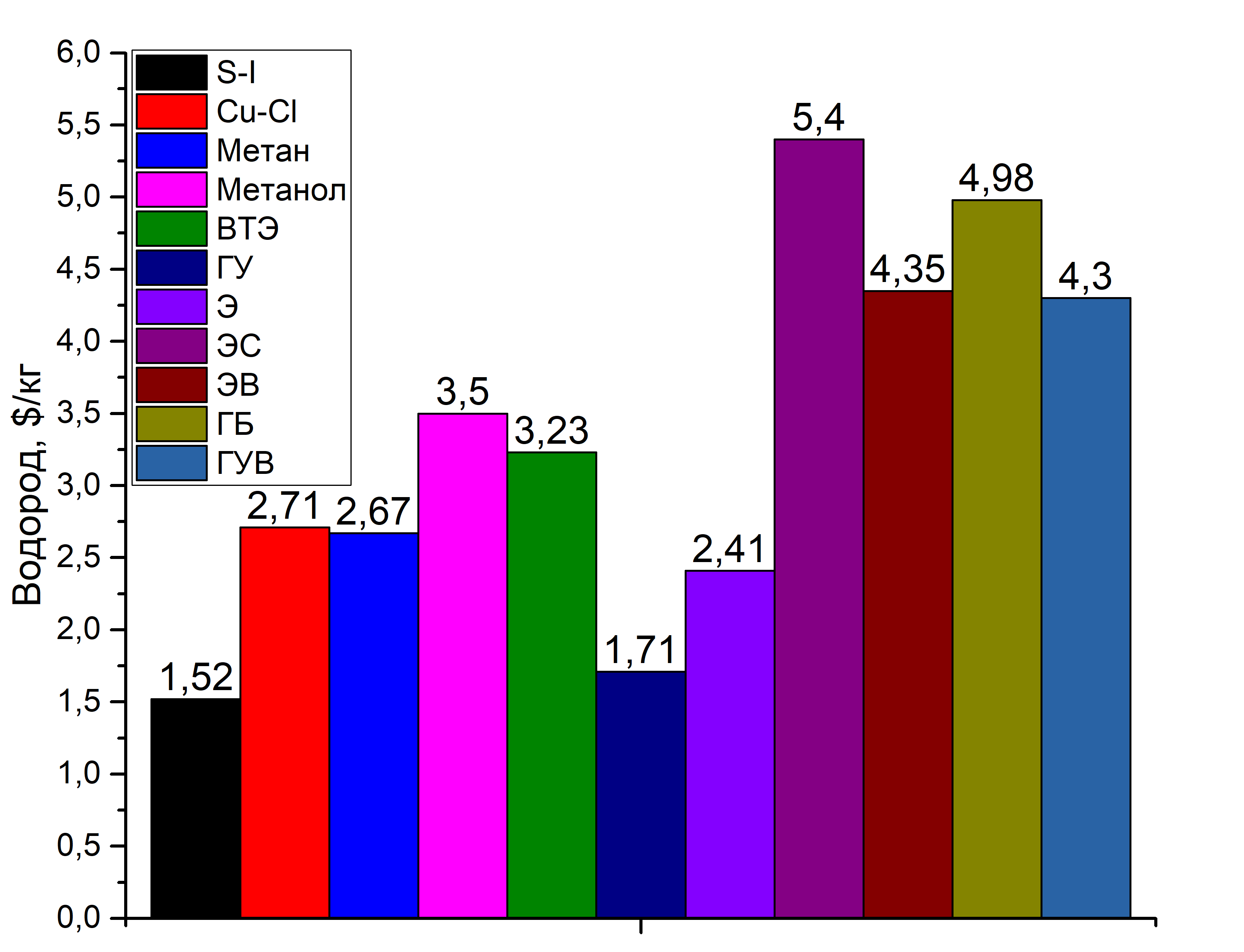
С точки зрения стоимости производства водорода самыми выгодными методами являются термохимические циклы S-I, Cu-Cl, газификация угля, паровая конверсия метана (паровой риформинг) и электролиз (в данном случае высокотемпературный). Вообще в различных документах по оценке производств нормальной стоимостью за килограмм водорода принимают интервал 3,5 – 4,5 $. Видно, что стоимость водорода при использовании солнечной энергии самая высокая, это, как я упоминал, связано с КПД менее 10% и дополнительной стоимостью электролизного оборудования, хотя по различным оценкам стоимость может заметно варьироваться. Если отбросить методы газификации и паровой конверсии, то самыми интересными становятся термохимические циклы и высокотемпературный электролиз [28-30]. До 76 % производимого промышленностью водорода используют в нефтеперерабатывающей промышленности (гидрообессеривание, гидрирование) и для синтеза различных химических соединений (аммиак и метанол = 19 % водорода), а также в металлургических процессах (в качестве восстановительной среды) [31]. В 2010 году было произведено около 58 миллионов тонн водорода. Основными препятствиями для широкомасштабного внедрения водорода как топлива являются небольшое число разработок и медленное внедрение двигателей на топливных элементах, очень высокие требования к чистоте водорода (< 100 ppm CO, топливные элементы крайне чувствительны к монооксиду углерода), отсутствие высокоёмких устройств хранения водорода. В общем на данный момент в водородной энергетике особо не заинтересованы, сейчас все бросили на электромобили на литий-ионных батареях. Наиболее широко применяемые методы производства водорода далеки от экологически чистых, стоимость заводов по производству водорода - сотни миллионов зеленых президентов (и это по оценкам до кризиса 2008 года и до низкой стоимости нефти).
Проверку на уникальность сделать не смог, т.к text.ru многобукв ниасилил.
Ссылки:
- S.A. Sherif, D. Yogi Goswami Elias K. Stefanakos, Aldo Steinfeld. Handbook of Hydrogen Energy. CRC Press Taylor & Francis Group. 2014.
- Bockris, J.O’M., Energy: The Solar-Hydrogen Alternative, Halsted Press, New York, 1975.
- Veziroglu, T.N. and Barbir, F., Hydrogen: The wonder fuel, Int. J. Hydrogen Energy, 17(6), 391–404, 1992.
- Rand DAJ, Dell RM. Fuels e hydrogen productionjcoal gasification. Encyclopedia of Electrochemical Power Sources; 2009. p. 276e92.
- Bonner, M., Botts, T., McBreen, J., Mezzina, A., Salzano, F., and Yang, C., Status of advanced electrolytic hydrogen production in the United States and Abroad, Int. J. Hydrogen Energy, 9(4), 269–275, 1984.
- Wendt, H., Water splitting methods, in C.-J. Winter and J. Nitsch (eds.), Hydrogen as an Energy Carrier, Springer-Verlag, Berlin/Heidelberg, Germany, pp. 166–238, 1988.
- Liepa, M.A. and Borhan, A., High-temperature steam electrolysis: Technical and economic evaluation of alternative process designs, Int. J. Hydrogen Energy, 11(7), 435–442, 1986.
- Э.Э. Шпильрайн. Введение в водородную энергетику. Энергоатомиздат. 1984 (на удивление актуальная книга, хорошо соотносится с первым справочником).
- Dincer I, Zamfirescu C. Sustainable hydrogen production options and the role of IAHE. Int J Hydrogen Energy 2012;37:16266e86.
- Hancock, Jr., O.G., A photovoltaic-powered water electrolyzer: Its performance and economics, in T.N. Veziroglu and J.B. Taylor (eds.), Hydrogen Energy Progress V, Pergamon Press, New York, pp. 335–344, 1984.
- Blank, H. and Szyszka, A., Solar hydrogen demonstration plant in Neunburg vorm Wald, in T.N. Veziroglu, C. Derive, and J. Pottier (eds.), Hydrogen Energy Progress IX, Vol. 2, M.C.I., Paris, France, pp. 677–686, 1992.
- Grasse, W., Oster, F., and Aba-Oud, H., HYSOLAR: The German-Saudi Arabian program on solar hydrogen—5 years of experience, Int. J. Hydrogen Energy, 17(1), 1–8, 1992.
- Lehman, P. and Chamberlain, C.E., Design of a photovoltaic-hydrogen-fuel cell energy system, Int. J. Hydrogen Energy, 16(5), 349–352, 1991.
- Lund, P.D., Optimization of stand-alone photovoltaic system with hydrogen storage for total energy self-suficiency, Int. J. Hydrogen Energy, 16(11), 735–740, 1991.
- Garcia-Conde, A.G. and Rosa, F., Solar hydrogen production: A Spanish experience, in T.N. Veziroglu, C. Derive, and J. Pottier (eds.), Hydrogen Energy Progress IX, Vol. 2, M.C.I., Paris, France, pp. 723–732, 1992.
- Wang ZL, Naterer GF, Gabriel KS, Gravelsins R, Daggupati VN. Comparison of sulfureiodine and copperechlorine thermochemical hydrogen production cycles. Int J Hydrogen Energy 2010;35:4820e30.
- Wendt, H., Water splitting methods, in C.-J. Winter and J. Nitsch (eds.), Hydrogen as an Energy Carrier, Springer-Verlag, Berlin/Heidelberg, Germany, pp. 166–238, 1988.
- Engels, H. et al., Thermochemical hydrogen production, Int. J. Hydrogen Energy, 12(5), 291–295, 1987.
- Yalcin, S., A review of nuclear hydrogen production, Int. J. Hydrogen Energy, 14(8), 551–561, 1989.
- Canan Acar, Ibrahim Dincer/ Comparative assessment of hydrogen production methods from renewable and non-renewable sources. Int. journal of hydrogen energy (2013) 2012
- Willner, I. and Steinberger-Willner, B., Solar hydrogen production through photo-biological, photochemical and photoelectrochemical assemblies, Int. J. Hydrogen Energy, 13(10), 593–604, 1988.
- Blaise A. Pinaud,a Jesse D. Benck,aLinsey C. Seitz,a Arnold J. Forman, ZheboChen, Todd G. Deutsch, Brian D. James, Kevin N. Baum, George N. Baum, Shane Ardo,HeliWang, Eric Millere and Thomas F. Jaramillo. Technical and economic feasibility of centralized facilities for solar hydrogen production via photocatalysis and photoelectrochemistry. DOI: 10.1039/c3ee40831
- Johanna Ivy Levene *, Margaret K. Mann, Robert M. Margolis, Anelia Milbrandt. An analysis of hydrogen production from renewable electricity sources. Solar Energy 81 (2007) 773–780.
- Parry ML, Canziani OF, Palutikof JP, van der Linden PJ, Hanson CE. Contribution of working group II to the fourth assessment report of the intergovernmental panel on climate change. Cambridge University Press; 2007.
- National Hydrogen Association, The hydrogen technology assessment, phase I. A report for NASA, Washington, DC, 1991.
- Simbeck DR, Chang E. Hydrogen Supply cost Estimate for Hydrogen Pathways - Scoping Anal. National renewable energy Laboratory; 2002.
- S. T. MIRABALAN ECONOMIC ANALYSIS OF HYDROGEN PRODUCTION TECHNOLOGIES USING RENEWABLE ENERGY RESOURCES.
- Simbeck D, Chang E. Hydrogen supply: cost estimate for hydrogen pathways e scoping analysis. National Renewable Energy Laboratory.
- Hydrogen from coal gasification: An economical pathway to a sustainable energy future Gary J.Stiegel 30. 30. Massood Ramezan Rami Salah El-Emamab Hasan OzcanaIbrahim Dincerac Comparative cost evaluation of nuclear hydrogen production methods with the Hydrogen Economy Evaluation Program (HEEP) https://doi.org/10.1016/j.ijhydene.2014.12.098
- Z.L. Wang, G.F. Naterer, K.S. Gabriel, R. Gravelsins, V.N. Daggupati. Comparison of sulfur–iodine and copper–chlorine thermochemical hydrogen production cycles. , Int. J. Hydrogen Energy 35 (2010) 4820–4830.
D.Brown. US HydrogenProduction – 2015. PacificNorthwestNationalLaboratory .